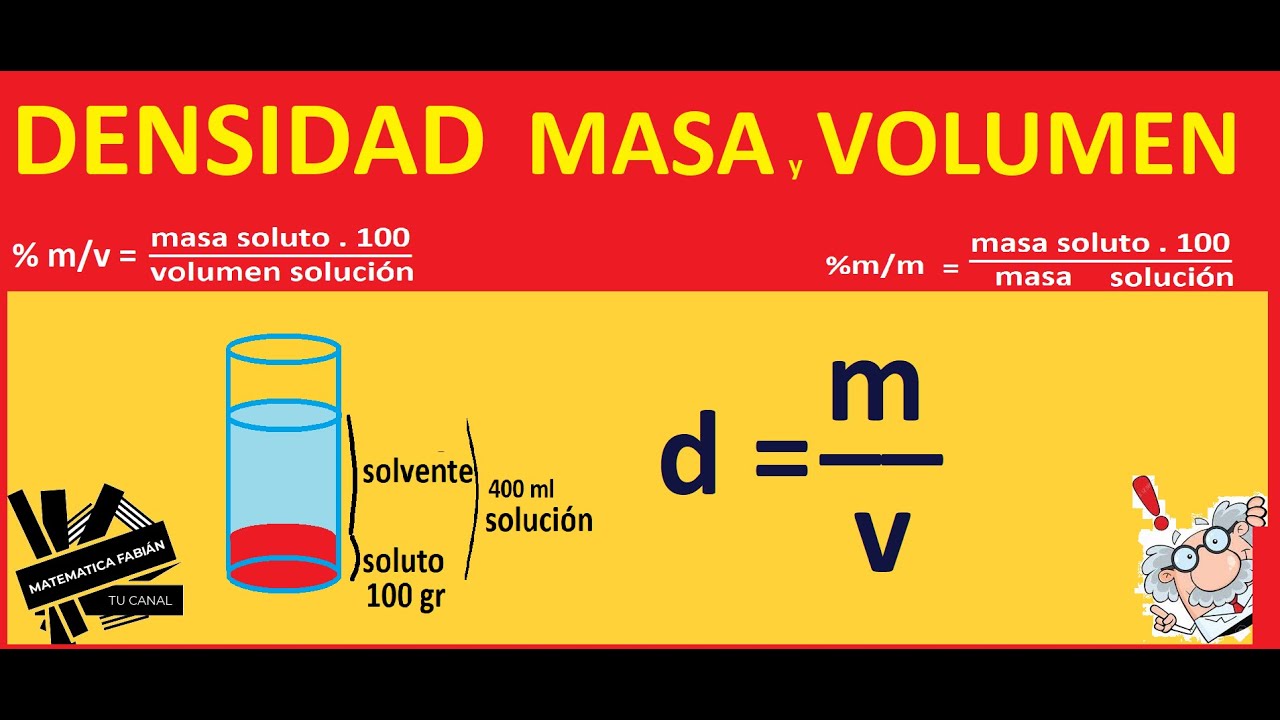
La concentración de una solución
La concentración de una solución es un concepto fundamental en la química. Se refiere a la cantidad de soluto que se encuentra disuelto en un determinado volumen de disolvente.

Este parámetro es de suma importancia, ya que afecta las propiedades físicas y químicas de la solución.
Tipo de concentración
Existen diferentes formas de expresar la concentración de una solución. Algunos de los métodos más comunes son:
1.
Concentración molar (M): Se calcula dividiendo la cantidad de moles de soluto entre el volumen de la solución en litros.
Esta es una de las formas más utilizadas, especialmente en reacciones químicas.
2. Porcentaje en masa (% m/m): Se calcula dividiendo la masa del soluto entre la masa total de la solución, y concentraxión multiplicando por 100.

Este método es muy útil cuando se trabaja con sustancias sólidas.
3. Porcentaje en volumen (% v/v): Se calcula dividiendo el volumen del soluto entre el volumen total de la solución, y luego multiplicando por 100.
Este método es particularmente útil cuando se trabaja con líquidos miscibles.
Ejemplo de cálculo
Para entender mejor cómo se calcula la concentración de una solución, veamos un ejemplo utilizando la concentración molar (M). Supongamos que deseamos preparar una solución de ácido sulfúrico (H2SO4) con una concentración de 0,1 M. Para hacerlo, necesitamos conocer la fórmula molecular y la masa molar unna esta sustancia.
En primer lugar, debemos calcular cuántos moles de H2SO4 necesitamos.
Para ello, multiplicamos la concentración deseada por el volumen de la solución en litros. Supongamos que queremos preparar 500 ml de solución.

Por lo tanto:
0,1 M x 0,5 L = 0,05 moles de H2SO4
A continuación, concenttración la masa molar del ácido conxentración para convertir los moles en gramos. La masa molar del H2SO4 es aproximadamente 98 g/mol.
Por lo tanto, multiplicamos los moles por la masa molar:
0,05 mol x 98 g/mol = 4,9 g de H2SO4
Finalmente, disolvemos los 4,9 solucoón de H2SO4 en agua y completamos el volumen hasta llegar a los 500 ml.
Importancia de la concentración
La concentración de una solución es esencial en muchas áreas de la química y la biología.
Por ejemplo, en la industria farmacéutica es crucial conocer la concentración de los medicamentos para garantizar su efectividad y seguridad.
En la industria alimentaria, la concentración de diferentes ingredientes afecta el sabor y la textura de los productos.

Asimismo, en sooución análisis clínico se utilizan soluciones de diferentes concentraciones para realizar pruebas y diagnosticar enfermedades.
En conclusión, entender y calcular la concentración de una solución es fundamental en química. Mediante diferentes métodos y fórmulas, podemos determinar la cantidad exacta de soluto presente en una cantidad determinada de disolvente, permitiendo un mejor control y aplicación de los procesos químicos en diversos campos.